
28.11.2022
Bruton-Tyrosinkinasehemmer (BTK) – die nächste Klasse von MS-Mitteln?
Bruton-Tyrosinkinase-Hemmer, kurz BTKi, sind keineswegs neu. Man kennt sie aus der Krebstherapie und überprüft derzeit den Einsatz bei MS. Gibt es also bald eine neue Wirkstoffklasse bei Multipler Sklerose?
Verschiedene Tyrosinkinasehemmer werden derzeit inPhase III-Studien auf die klinischen Wirksamkeit und Sicherheit geprüft. Das Studienprogramm umfasst sowohl die schubförmigen Verlaufsformen (RRMS und SPMS mit Schüben) als auch die progredienten Verlaufsformen der Multiplen Sklerose (PPMS und SPMS ohne aufgesetzte Schübe) (1). Aktuell wird der erste Patient in Deutschland in eine der Phase III-Studien aufgenommen.Das Ziel: Hemmung der Neuroinflammation und Neurodegeneration!
Es handelt sich um einen gehirngängigen selektiven niedermolekularen Wirkstoff, der oral eingenommen wird. Er moduliert sowohl Zellen des adaptiven Immunsystems (aktivierte B-Zellen) als auch solche des angeborenen Immunsystems (aktivierte Makrophagen und Mikrogliazellen des ZNS), von denen angenommen wird, dass sie u.a. an der Neuroinflammation und Neurodegeneration im Gehirn und im Rückenmark beteiligt sind.
Konkret wird der BTK-Inhibitor in einer Dosierung von 60 mg einmal täglich in 2 Phase III-Studien bei Patienten mit schubförmiger MS (RRMS) erprobt. Primärer Endpunkt ist in die Schubrate. Die Vergleichssubstanz ist Teriflunomid in einer Dosierung von 14 mg einmal täglich.
In weiteren Studien werden BTK bei der sekundär progredienten MS ohne aufgesetzte Schübe (SPMS) geprüft und auch bei der primär progredienten MS (PPMS). Primärer Endpunkt ist in diesen beiden Studien die Zeit bis zum Beginn der 6-monatigen bestätigten Behinderungsprogression. In beiden Studien wird der BTK-Inhibitor gegen Placebo getestet.
Hoffnung auf kausalen Wirkansatz: Hintergrund des breit angelegten Studienprogramms ist die Tatsache, dass es nach wie vor bei der überwiegenden Mehrzahl der Patienten mit Multipler Sklerose im Verlauf ihrer MS-Erkrankung zu einer Zunahme von Behinderung kommt. Der besondere Wirkmechanismus des BTK-Inhibitors gibt zu der Hoffnung Anlass, dass das Molekül die erste bei den B-Zellen ansetzende MS-Therapie sein könnte, die nicht nur im Bereich des peripheren Immunsystems seine Wirksamkeit entfaltet. Vielmehr kann der Wirkstoff auch die Blut-Hirn-Schranke überwinden und wahrscheinlich auf diese Weise ins Gehirn eingewanderte Immunzellen unterdrücken und gleichzeitig die Mikrogliazellen im Gehirn modulieren, die mit dem Fortschreiten der MS in Verbindung gebracht werden.
Es könnte womöglich um die erste krankheitsmodifizierende Therapie handeln, die bei den Ursachen der Schädigung durch die Multiple Sklerose im Gehirn ansetzt.
Derzeit werden drei BTK-Inhibitoren gegen MS getestet: EVOBRUTINIB, FENEBRUTINIB und TOLEBRUTINIB
Vor einer möglichen Zulassung müssen alle drei Wirkstoffe neben ihrer Wirksamkeit erst zeigen, ob und welche Nebenwirkungen auftreten können
5/2022
Kesimpta in österreich verschreibbar
15.12.2021
PONESIMOD (ponvory
Ponesimod (Ponvory®) ist ein selektiver Sphingosin-1-Phosphat-Rezeptor-1-(S1P1) -Modulator, eine Klasse von Medikamenten, die die S1P-Aktivität funktionell hemmen und damit unter anderem die Anzahl der zirkulierenden Lymphozyten reduzieren sollen. Ponesimod gesellt sich damit zu den bereits zugelassenen Wirkstoffen Fingolimod, Siponimod und Ozanimod. Ponesimod bindetspeziell an den S1P-Rezeptor 1, der sich auf Lymphozyten befindet, und blockiert so die Fähigkeit der Lymphozyten, aus den Lymphknoten auszutreten, und verringert die Anzahl der Lymphozyten im peripheren Blut.
Der Nutzen von Ponesimod besteht in der Verhinderung von Schüben und dem Auftreten neuer fokaler entzündlicher Läsionen im ZNS. Die Zulassung stützt sich auf Daten der Phase-III-Studie OPTIMUM. Darin wurde die Wirksamkeit, Sicherheit und Verträglichkeit von Ponesimod 20 mg im direkten Vergleich zu Teriflunomid 14 mg bei mehr als 1100 Patienten mit schubförmig remittierender MS (RRMS) untersucht. Die Studiendauer betrug 108 Wochen.
Das Präparat wird – wie die anderen verfügbaren S1P Modulatoren auch – 1x pro Tag eingenommen. Ein Monitoring nach der ersten Dosis ist nicht vorgeschrieben. Patienten mit bestimmten kardialen Vorerkrankungen sollen allerdings vier Stunden überwacht werden.
Die Halbwertszeit beträgt 33 Stunden, die Auswaschzeit ca. eine Woche. Der Einfluss von Ponesimod auf das Immunsystem ist damit schnell reversibel, theoretisch ist damit innerhalb von nur einer Woche eine Normalisierung der Lymphozytenzahl möglich, was eine zusätzliche Flexibilität im Behandlungsmanagement bietet. Dieses kann z.B. bei anstehenden Impfungen, schweren Infektionen oder der Familienplanung eine wichtige Rolle spielen.
01.05. 2021
Ofatumumab (Kesimpta®)
Die Europäische Kommission hat das Arzneimittel Ofatumumab (Handelsname: Kesimpta®) zur Behandlung Erwachsener mit schubförmiger Multipler Sklerose (RMS) mit aktiver Erkrankung zugelassen. Bei dem Medikament handelt es sich um einen B-Zell-Antikörper zur Eigenapplikation.
Basierend auf der Empfehlung durch die Europäischen Arzneimittel-Agentur für die Zulassung von Ofatumumab zur Therapie von erwachsenen Personen mit schubförmiger Multipler Sklerose (RMS) mit aktiver Erkrankung hat die Europäische Kommission den Anti-CD-20-Antikörper zulassen.
Der monoklonale Antikörper Ofatumumab wirkt über eine gezielte Verminderung gezielter B-Zellen des Immunsystems, die bei Immunangriffen auf das Gehirn und das Rückenmark eine Rolle spielen. Meldungen der EMA zufolge kann Ofatumumab Multiple Sklerose-Schübe verhindern und die Behinderungsprogression verlangsamen.
B-Zell-Therapie wird mit Autoinjektor-Pen gespritzt
Den Wirkstoff Ofatumumab können sich Menschen mit schubförmiger Multipler Sklerose mit aktiver Erkrankung (definiert durch einen klinischen Befund oder Bildgebung) nach drei Initialdosen, die innerhalb von zwei Wochen verabreicht werden, mit einer Fertigspritze selbst unter die Haut spritzen.
Bevor Ofatumumab in den Erstattungskodex der Österreichischen Sozialversicherung aufgenommen wird und somit auf Rezept erhältlich ist, muss ein Antragsverfahren in Österreich absolviert werden.
Information Multiple Sklerose und SARS-COV2/COVID19 #4 | 01.03.2021
gegenüber unseren früheren Informationen/Empfehlungen zum Risiko und Management von MS Patient*innen im Kontext der SARS-CoV2 Pandemie (#1 vom 30.3. und #2 vom 8.5.2020) haben sich keine Änderungen ergeben.
Hingegen gibt es seit der Information/Empfehlung zu den SARS-CoV2 Impfungen und MS vom 8.1.2021 mittlerweile neue virologische, immunologische und pharmakologische Erkenntnisse, die wir als klinisch relevant erachten und Sie daher aktuell informieren möchten.
Aktualisierte Informationen und Empfehlungen zur SARS-COV2 Impfung für MS Patient*innen
• Die Diagnose MS stellt prinzipiell keine Kontraindikation gegen Impfungen dar.
• Impfungen mit Totimpfstoffen können uneingeschränkt bei MS Patient*innen durchgeführt werden.
• Die in Europa zugelassenen SARS-CoV2 Impfungen der Hersteller Biontech/Pfizer bzw. Moderna sind sogenannte mRNA Impfstoffe und damit konzeptuell Totimpfstoffe.
• Die zuletzt in Europa zugelassene SARS-CoV2 Impfung des Herstellers Oxford/AstraZeneca ist ein sogenannter Vektor-basierter Impfstoff. Im Gegensatz zu früher ist mittlerweile klar, dass dieser Vektor- basierte Impfstoff kein Lebendimpfstoff mit vermehrungsfähigen, krankheitsspezifischen Erregern ist, sondern einen nicht pathogenen und nicht replikationsfähigen Adenovirus-Vektor enthält, der als „Vehikel“ die genetische Sequenz des pathogenen Oberflächen-Spike-Proteins von SARS-CoV2 transportiert und derart die körpereigene spezifische Immunantwort gegen das SARS-CoV2 auslöst.
——————————————————————————————————————————————————————————
• Zur Priorisierung von MS Patient*innen für eine SARS-CoV2 Impfung erlauben wir auf die aktuelle Version des Nationalen Impfplans zu verweisen: https://www.sozialministerium.at/Corona-Schutzimpfung/Corona-Schutzimpfung—Durchfuehrung-und- Organisation.html
• Jede Impfung, so auch eine SARS-CoV2 Impfung, kann aufgrund ihres (erwünschten) immunologischen Wirkmechanismus eine Impfreaktion im Sinne von grippeähnlichen Symptomen (Fieber, Muskelschmerzen, Abgeschlagenheit, u.Ä.) für 24-48h verursachen. Bei MS Patient*innen kann eine solche Impfreaktion daher zu einem Uhthoff’schen Phänomen („Pseudoschub“) führen. Ein entsprechendes vorausschauendes Management, beispielsweise mit Nicht-steroidalen Antirheumatika (NSAR), sollte demnach erwogen werden.
• Grundsätzlich sollte die SARS-CoV2 Impfung – so wie jede andere Impfung – zumindest 6 Wochen vor Beginn einer krankheitsmodifizierenden Therapie (DMT) appliziert werden.
!eine Impfung gegen SARS-CoV2 mit einem mRNA Impfstoff ist daher bei MS Patient*innen möglich und empfohlen.
Die Vektor-basierte Impfung gegen SARS-CoV2 ist daher konzeptuell einem Totimpfstoff vergleichbar und somit auch bei MS Patient*innen möglich und empfohlen.
Wenn eine Impfung, so auch eine SARS-CoV2 Impfung, unter laufender DMT erfolgt, dann sind folgende Überlegungen/Vorgehensweisen zu beachten:
a) Zur Wirksamkeit von Impfungen unter laufender DMT gibt es insgesamt nur begrenzte Daten.
b) Anhand bisheriger Erfahrungen mit anderen Impfungen kann angenommen werden, dass unter Therapie mit Dimethylfumarat, Glatiramerazetat, Interferon-ß Präparaten, Natalizumab und Teriflunomid grundsätzlich ein ausreichender Impfschutz bestehen dürfte.
c) Im Gegensatz dazu kann bei bestehender Therapie mit Fingolimod (analog mit Ozanimod undSiponimod) die Impfantwort vermindert sein.
d) Bei zyklisch verabreichten immunsuppressiven DMT (Alemtuzumab, Cladribin, Ocrelizumab,Rituximab) sollten Impfungen mit Totimpfstoffen, so auch eine SARS-CoV2 Impfung, frühestens 4 Monate nach der letzten Gabe der Therapie durchgeführt werden.
e) Im Zweifelsfall kann der Impfschutz gängiger Impfungen serologisch (sog. „Impftiter“) überprüft werden. Dies ist aber für eine SARS-CoV2 Impfung derzeit noch nicht routinemäßig verfügbar.
Urheber: Univ. Prof. Dr. Thomas Berger und Univ. Prof. Priv. Doz. Dr. Christian Enzinger
04.02.2012
COVID-19 und Multiple Sklerose: update Globale Empfehlungen zur Impfung
Aktuelle Erkenntnisse zeigen, dass die Wahrscheinlichkeit, COVID-19 zu entwickeln, schwer zu erkranken oder an den Folgen der Infektion zu versterben bei Menschen mit einer MS-Diagnose generell nicht höher ist als in der allgemeinen Bevölkerung. Folgende Gruppen von MS-Betroffenen sind jedoch anfälliger für einen schweren COVID-19-Verlauf:
- Menschen mit progressiver MS
- Menschen mit MS über 60 Jahren
- Männer mit MS
- Schwarze und möglicherweise südasiatische Menschen mit MS
- Menschen mit einem höheren Grad an Behinderung (z.B. einem EDSS-Wert von 6 oder höher)
- Menschen mit MS und Adipositas, Diabetes oder Erkrankungen des Herzens oder der Lunge
- Menschen, die bestimmte krankheitsmodifizierende Therapien für ihre MS einnehmen (siehe unten)
Allen MS-Betroffenen wird empfohlen, die Richtlinien der Weltgesundheitsorganisation zu befolgen, um das Infektionsrisiko mit COVID-19 zu verringern. Personen in den höheren Risikogruppen sollten diesen Maßnahmen besondere Aufmerksamkeit widmen.
MSIF-Empfehlungen zu krankheitsmodifizierenden Therapien
Viele krankheitsmodifizierende Therapien (DMTs) für MS wirken durch die Unterdrückung bzw. Modifizierung des Immunsystems. Einige MS-Medikamente können die Wahrscheinlichkeit erhöhen, dass bei einer Infektion mit COVID-19 Komplikationen auftreten. Dieses Risiko muss jedoch mit dem Risiko eines Abbruchs oder einer Verzögerung der Behandlung in Einklang gebracht werden.
Die Internationale Multiple Sklerose Föderation empfiehlt Menschen mit MS, die derzeit krankheitsmodifizierende Therapien erhalten, ihre Behandlung fortzusetzen – es sei denn, es wird empfohlen, die behandelnde Ärztin bzw. den behandelnden Arzt zu konsultieren.
Personen, die Symptome von COVID-19 entwickeln oder positiv auf die Infektion getestet werden, sollten ihre MS-Therapien mit ihrer behandelnden Ärztin bzw. ihren behandelnden Arzt oder anderem mit ihrer Pflege vertrauten medizinischen Fachpersonal besprechen.
Bevor Menschen mit MS mit einer neuen krankheitsmodifizierenden Therapien beginnen oder eine bestehende krankheitsmodifizierende Therapien ändern, sollten mit ihrer behandelnden Ärztin bzw. ihren behandelnden Arzt besprechen, welche Therapie für ihre individuellen Umstände die beste Wahl ist. Diese Entscheidung sollte die folgenden Informationen berücksichtigen:
- Verlauf und Aktivität der MS-Erkrankung
- Risiken und Vorteile, die üblicherweise mit verschiedenen Behandlungsoptionen verbunden sind
- Zusätzliche Risiken im Zusammenhang mit COVID-19, wie beispielsweise
– das Vorhandensein anderer Faktoren für einen schwereren Fall von COVID-19 wie Alter, Adipositas, bestehende Lungen- oder Herz-Kreislauf-Erkrankungen, progressive MS, ethnische Zugehörigkeit mit höherem Risiko usw. (wie oben angeführt)
– das aktuelle und erwartete zukünftige COVID-19-Risiko in der Region
– durchgemachte Infektion mit COVID-19
– Verfügbarkeit und Zugang zu einem COVID-19-Impfstoff
Hinweise auf den Einfluss krankheitsmodifizierender Therapien auf den Schweregrad von COVID-19
Es ist unwahrscheinlich, dass Interferone und Glatirameracetat den Schweregrad von COVID-19 negativ beeinflussen. Es gibt einige vorläufige Hinweise darauf, dass Interferone aufgrund von COVID-19 die Notwendigkeit einer Krankenhauseinweisung reduzieren können.
Die verfügbaren Daten deuten darauf hin, dass Menschen mit MS, die Dimethylfumarat, Teriflunomid, Fingolimod, Siponimod und Natalizumab einnehmen, kein erhöhtes Risiko für schwerwiegendere COVID-19-Symptome haben.
Es gibt Hinweise darauf, dass Therapien gegen CD20 – Ocrelizumab und Rituximab – mit einer erhöhten Wahrscheinlichkeit einer schwereren Form von COVID-19 assoziiert sein können. Diese Therapien sollten jedoch weiterhin als Option für die Behandlung von MS während der Pandemie in Betracht gezogen werden. Menschen mit MS, die diese Therapien erhalten (oder Ofatumumab und Ublituximab, die auf die gleiche Weise wirken), sollten hinsichtlich der oben genannten Ratschläge besonders wachsam sein, um das Infektionsrisiko zu verringern.
Weitere Daten zur Anwendung von Alemtuzumab und Cladribin während der COVID-19-Pandemie sind erforderlich, um deren Sicherheit beurteilen zu können. Menschen mit MS, die derzeit diese Therapien erhalten und in einer Region mit einem COVID-19-Ausbruch leben, sollten ihre aktuellen Lymphozytenzahlen mit ihrer behandelnden Ärztin bzw. ihrem behandelnden Arzt besprechen. (Lymphozyten sind eine Art weißer Blutkörperchen, die den Körper vor Infektionen schützen. Wenn deren Anzahl als niedrig angesehen wird, sollten sich Betroffene so viel wie möglich isolieren, um ihr Risiko zu verringern.)
Die Empfehlungen zur Verzögerung der zweiten oder weiteren Dosierung von Alemtuzumab, Cladribin, Ocrelizumab und Rituximab aufgrund des COVID-19-Ausbruchs sind von Land zu Land unterschiedlich. Personen, die diese Medikamente einnehmen und die nächste Dosis erhalten müssen, sollten ihre behandelnde Ärztin bzw. ihren behandelnden Arzt zu die Risiken und Vorteile einer Verschiebung der Behandlung befragen.
Ärztlicher Rat bei Schüben und anderen gesundheitlichen Problemen
Die Verwendung von Steroiden zur Behandlung von Rückfällen sollte sorgfältig abgewogen und nur bei schweren Rückfällen angewendet werden. Es gibt Hinweise darauf, dass die Einnahme hochdosierter Steroide im Monat vor der Ansteckung mit COVID-19 das Risiko einer schwereren Infektion erhöht, die einen Krankenhausbesuch erfordert. Wenn möglich, sollte die Entscheidung von einer Neurologin bzw. einem Neurologen getroffen werden, der oder die Erfahrung in der Behandlung von MS hat. Menschen, die wegen eines Schubs eine Steroidbehandlung erhalten, sollten besonders wachsam sein und mindestens einen Monat lang über eine Selbstisolierung nachdenken, um das Risiko von COVID-19 zu verringern.
Menschen mit MS sollten weiterhin an Rehabilitationsmaßnahmen teilnehmen und während der Pandemie so aktiv wie möglich bleiben. Dies kann durch Online-Sitzungen erfolgen – sofern verfügbar – oder in Kliniken, sofern die Einrichtungen Sicherheitsvorkehrungen treffen, um die Verbreitung von COVID-19 zu begrenzen. Menschen mit Bedenken hinsichtlich ihrer psychischen Gesundheit sollten sich beraten lassen.
SARS-CoV-2-Impfstoff
Derzeit sind nicht genügend Informationen verfügbar, um kommentieren zu können, wie die verschiedenen in der Entwicklung befindlichen SARS-CoV-2-Impfstoffe mit MS oder mit krankheitsmodifizierenden Therapien für MS interagieren würden. Hinweise werden in einer aktualisierten Version der MSIF-Erklärung enthalten sein, sobald sie verfügbar sind.
Beratung für Kinder oder schwangere Frauen mit MS
Derzeit gibt es keine spezifischen Empfehlungen für schwangere Frauen mit MS. Es gibt seitens der Weltgesundheitsorganisation allgemeine Informationen zu COVID-19 und Schwangerschaft, aber keine spezifischen Ratschläge für von MS betroffene Kinder. Diese Personengruppen sollten den obigen Ratschlägen für Menschen mit MS folgen.
COVID-19 mRNA-Impfstoffe (Pfizer-BioNTech und Moderna) und MS
Die Leitlinien beziehen sich derzeit nur auf die mRNA-Impfstoffe (Pfizer-BioNTech und Moderna), da diese von klinischen und wissenschaftlichen Expertinnen und Experten bewertet wurden.
Die mRNA-Impfstoffe verwenden einen Teil des genetischen Codes des Coronavirus, um eine Reaktion des menschlichen Immunsystems auszulösen, welches wiederum bei der geimpften Person eine Reaktion auslöst, durch die Antikörper und T-Zell-Zellen zur Bekämpfung des Virus produziert werden. Alle Daten zu diesen mRNA-COVID-19-Impfstoffen stammen aus klinischen Studien, die sorgfältig und gründlich überprüft und von den Aufsichtsbehörden genehmigt wurden.
Wir wissen nicht, wie viele der Teilnehmerinnen und Teilnehmer an den klinischen Studien mit mRNA-Impfstoffen von Multipler Sklerose betroffen waren. Somit liegen auch noch keine Daten zur Sicherheit und Wirksamkeit von mRNA-COVID-19-Impfstoffen speziell für Menschen mit MS vor. Die Leitlinien basieren daher auf den Daten der Allgemeinbevölkerung in den klinischen Impfstoffstudien und auf bislang gemachte Erfahrungen mit der Impfung von Menschen mit MS.
Menschen mit Multipler Sklerose sollten sich impfen lassen
Die Wissenschaft hat dargelegt, dass die COVID-19-mRNA-Impfstoffe (Pfizer-BioNTech und Moderna) sicher und wirksam sind. Wie auch bei anderen medizinischen Entscheidungen wird die Entscheidung für einen Impfstoff am besten gemeinsam zwischen der behandelnden Neurologin bzw. dem behandelnden Neurologen und der von MS betroffenen Person getroffen. Menschen mit MS sollten den mRNA-Impfstoff (Pfizer-BioNTech oder Moderna) erhalten, sobald dieser zur Verfügung steht. Die Risiken einer COVID-19-Krankheit überwiegen alle potenziellen Risiken des Impfstoffs. Darüber hinaus sollten Haushaltsangehörige und enge Kontaktpersonen von MS-Betroffenen einen mRNA-Impfstoff (Pfizer-BioNTech oder Moderna) erhalten, sofern dieser verfügbar ist. Damit lassen sich die Auswirkungen des Virus reduzieren. Die COVID-19-Impfstoffe von Pfizer-BioNTech und Moderna müssen in zwei Dosen verabreicht werden. Auch wenn MS-Betroffene bereits eine SARS-COV-2-Infektion durchgemacht haben, wird eine Impfung empfohlen.
Menschen mit progressiver Multipler Sklerose, ältere Menschen sowie jene mit einem höheren körperlichen Behinderungsgrad, Erkrankungen wie beispielsweise Diabetes, Bluthochdruck, Adipositas sowie Herz- und Lungenerkrankungen sowie schwarze und möglicherweise auch südasiatischn MS-Betroffene zählen zu den Gruppen mit dem höchsten Risiko, dass aufgrund von COVID-19 ein Spitalsaufenthalt notwendig wird.
mRNA-Impfstoffe sind für Menschen mit Multipler Sklerose sicher
mRNA-Impfstoffe (Pfizer-BioNTech und Moderna) enthalten kein lebendes Virus und verursachen keine COVID-19-Erkrankung. Die mRNA-Impfstoffe (Pfizer-BioNTech und Moderna) lösen wahrscheinlich auch keinen MS-Schub aus oder verschlimmern chronische MS-Symptome. Das Risiko, an COVID-19 zu erkranken, überwiegt bei weitem das Risiko eines möglicherweise durch eine Impfung ausgelösten MS-Schubs. Die mRNA-Impfstoffe (Pfizer-BioNTech und Moderna) können Nebenwirkungen wie Fieber oder Müdigkeit verursachen. Fieber kann zu einer vorübergehenden Verschlechterung der MS-Symptome führen. Nach dem Abklingen des Fiebers sollten die MS-Symptome auf das Niveau vor der Impfung zurückkehren. Wichtig: Auch wenn MS-Betroffene nach der ersten Teilimpfung von Nebenwirkungen betroffen sind, sollte die zweite Impfdosis verabreicht werden.
COVID-19 mRNA-Impfstoffe vertragen sich mit MS-Medikamenten
Die krankheitsmodifizierende Therapie (DMT) sollte fortgesetzt werden – es sei denn, die Neurologin bzw. der Neurologe rät zur Absetzung oder Verzögerung. Das plötzliche Absetzen einiger krankheitsmodifizierender Therapien kann nämlich eine rapide Verschlechterung der MS bewirken. Basierend auf Daten aus früheren Studien mit anderen Impfstoffen und krankheitsmodifizierenden Therapien gilt es als sicher, die mRNA-Impfstoffe (Pfizer-BioNTech oder Moderna) auch unter einer krankheitsmodifizierenden Therapie zu erhalten. Einige krankheitsmodifizierende Therapien können bewirken, dass der Impfstoff weniger wirksam ist, bieten aber dennoch einen gewissen Schutz. Bei MS-Betroffenen, die mit Ofatumumab, Alemtuzumab, Cladribin, Ocrelizumab oder Rituximab behandelt werden, muss möglicherweise der Zeitpunkt der Impfung mit dem Zeitpunkt der Therapiegabe koordiniert werden. Die behandelnde Neurologin bzw. der behandelnde Neurologe ermittelt den idealen Zeitpunkt.
16.01.2012Informationen und Empfehlungen zur SARS-COV2 Impfung für MS Patient*innen
- Je größer die Population, die gegen SARS-CoV2 geimpft ist, desto größer die notwendigerweise anzustrebende Herdenimmunität innerhalb einer Bevölkerung – und damit wird auch das Risiko, an COVID19 zu erkranken drastisch minimiert bzw. im günstigsten Fall eliminiert. Daher gibt es in Österreich eine generelle Empfehlung zur SARS-CoV2 Impfung.
- Die beiden aktuell in Europa aktuell zugelassenen SARS-CoV2 Impfungen sind sogenannte mRNA Impfstoffe (als Totimpfstoffe einzustufen), die in großen Studien eine jeweils nahezu 95%-ige Wirksamkeit (inklusive älterer Menschen bzw. jenen mit bekannten Risikofaktoren) zur Verhinderung einer SARS-CoV2 Infektion gezeigt haben.
- Die Diagnose MS stellt prinzipiell keine Kontraindikation gegen Impfungen dar.
- Impfungen mit Totimpfstoffen können bei MS Patient*innen durchgeführt werden. Somit ist eine mRNA Impfung gegen SARS-CoV2 auch bei MS Patient*innen möglich und empfohlen.Inwieweit dies betreffend Vector-Impfstoffe zutrifft ist derzeit noch in Diskussion
- Da in den nächsten Monaten nur begrenzte SARS-CoV2 Impfdosen zur Verfügung stehen werden, sollten vorrangig jene MS Patient*innen geimpft werden, die laut Tab 1 ein hohes/intermediäres Risiko aufweisen.
- Jede Impfung, so auch eine SARS-CoV2 Impfung, kann aufgrund ihres (erwünschten) immunologischen Wirkmechanismus eine Impfreaktion im Sinne von grippeähnlichen Symptomen (Fieber, Muskel- schmerzen, Abgeschlagenheit, u.Ä.) für 24-48h verursachen. Bei MS Patient*innen kann eine solche Impfreaktion daher zu einem Uhthoff’schen Phänomen (kein Schub, Symptome durch Temperaturerhöhung „reaktiviert) führen.
- Bei bestimmten DMT (Alemtuzumab, Cladribin, Fingolimod, Mitoxantron, Natalizumab, Ocrelizumab, Ozanimod, Rituximab und Siponimod) sind Lebendimpfstoffe kontraindiziert.
- Grundsätzlich ist die SARS-CoV2 Impfung, so wie jede andere Impfung (mit einem Tot- oder Lebend-impfstoff), wenn möglich zumindest 6 Wochen vor Beginn mit einer MS-Therapie empfohlen.
Wenn eine Impfung, so auch eine SARS-CoV2 Impfung, unter laufender MS-Therapie erfolgt, dann sind folgende
Überlegungen/ Vorgehensweise Betreff Covid-Impfung bei MS
- Zur Wirksamkeit von Impfungen unter laufender DMT gibt es insgesamt nur begrenzte Daten
- Anhand bisheriger Erfahrungen mit anderen Impfungen kann angenommen werden, dass unterTherapie mit Dimethylfumarat, Glatiramerazetat, Interferon-ß Präparaten, Natalizumab undTeriflunomid grundsätzlich ein ausreichender Impfschutz bestehen dürfte.
- Im Gegensatz dazu kann bei bestehender Therapie mit Fingolimod (analog mit Ozanimod und Siponimod) die Impfantwort vermindert sein
- Bei zyklisch verabreichten immunsuppressiven DMT (Alemtuzumab, Cladribin, Ocrelizumab,Rituximab) sollten Impfungen mit Totimpfstoffen, so auch eine SARS-CoV2 Impfung, frühestens 4Monate nach der letzten Gabe der Therapie durchgeführt werden. Im Zweifelsfall kann der Impfschutz gängiger Impfungen serologisch („Impftiter“) überprüft werden.Dies ist aber für eine SARS-CoV2 Impfung derzeit nicht verfügbar.
________________________________________________________________________________________________________________
30.12.2020
Impfungen gehören seit Jahrzehnten zu den wichtigsten prophylaktischen medizinischen Maßnahmen. Schwerwiegende Infektionserkrankungen wie Pocken oder Polio konnte durch Impfungen „ausgerottet“ werden
Eine Impfung ist von individuellem und auch gesellschaftlichen Nutzen sowie auch für die Gesellschaft : Wer geimpft ist, kann nicht nur selbst nicht mehr (schwer) erkranken, sondern auch niemand anderen mehr anstecken.
Aktuelle Impfstoffe gegen das Covid-19-Virus:
- Totimpfstoffe mit Virusprotein:
Sie bestehen aus ausgewählten Bestandteilen der Viren oder enthalten das gesamte Material inaktivierter Viren. Die meisten der gebräuchlichen Impfungen (z.B. Grippe, FSME, Hepatitis, Tetanus, etc.) sind so aufgebaut und dürfen bei MS-Betroffenen, unabhängig von der aktuellen Therapie, angewendet werden. - Virus-Vektor-Impfstoffe:
Für diese Impfungen werden lebende Viren, die aber für den Menschen nicht schädlich sind, verwendet. Das Virus trägt den Bauplan für Bestandteile des SARS-Cov2 Virus in sich und löst damit eine Immunreaktion beim Wirten aus. Der 2019 zugelassene Impfstoff gegen das Ebola-Virus basiert auf dem Prinzip des Virusvektors. Lebendimpfungen dürfen bei MS unter immunsuppressiver Therapie nicht angewendet werden. - mRNA/DNA Impfstoffe:
Sie enthalten Bestandteile des Virus, die den Bauplan für ein oder mehrere Virusproteine enthalten. Die mRNA wird in körpereigene Zellen aufgenommen und löst eine Immunantwort aus. Dieses Prinzip ist neu, es gibt dazu noch keinen Impfstoff auf dem Markt. Da es sich um einen Totimpfstoff handelt, sollte er auch bei MS-Betroffenen anwendbar sein.
Risikogruppen für einen schweren Verlauf einer SARS-Cov2 Infektion stellen vor allem ältere Personen und Personen mit Begleiterkrankungen dar. Die Multiple Sklerose erhöht das Risiko eines schweren Verlaufs zunächst nicht, es spielt jedoch die aktuelle Therapie und das Ausmaß der Behinderung eine Rolle. Unter immunsuppressiven Therapien besteht ganz allgemein ein erhöhtes Infektionsrisiko, sodass hier die Impfung einen Schutz bieten kann. Umgekehrt kann das Ansprechen auf eine Impfung unter immunsuppressiver Therapie abgeschwächt sein.
Welche Impfstoffe gegen das SARS-Cov2-Virus sind derzeit oder zeitnah verfügbar?:
In Anbetracht der durch die Pandemie global bedrohlichen Situation wurde für die Zulassung der neuen Impfstoffe v.S. europäischen Arzneimittel-Agentur (EMA) ein „Rolling-Review“ Verfahren angewandt.
Rolling-Review bedeutet, dass die Daten aus laufenden Studien bereits von der EMA geprüft werden, bevor der formelle Antrag zur offiziellen Zulassung überhaupt eingereicht wird. Dies ermöglicht eine schnelle Stellungnahme seitens der EMA, ob der Impfstoff die Sicherheits- und Wirksamkeitskriterien erfüllt und somit zugelassen werden kann. Bei diesen Schnellverfahren gelten jedoch die gleichen Regeln und Sicherheitsbestimmungen wie bei einem regulären Zulassungsverfahren.
Bereits zugelassen ist derzeit der von der Firma BioNTechin Kooperation mit Pizer entwickelte Impfstoff namens BNT162b2.
Dieser Impfstoff beruht auf einem neuen Prinzip, bei dem der Bauplan für bestimmte Eiweißstoffe des SARS-COV-2 Virus per messenger-RNA in den Menschen eingebracht wird. Dieser Bauplan wird von Zellen im menschlichen Körper aufgenommen und zusammengebaut. Gegen die dabei entstehenden Eiweißstoffe wird nun eine Immunreaktion gestartet, sodass der Körper im Falle einer Infektion mit SARS-COV-2 gerüstet ist. In Testphase 3, bei der mehr als 43.000 Teilnehmer eingeschlossen wurde, kamm es zu keinen schwerwiegenden Nebenwirkungen. Die errechnete Wirksamkeit betrug ca. 90 %. An Nebenwirkungen wurden berichtet: Müdigkeit, Abgeschlagenheit und Kopfschmerzen. Impfstoff Die logistische Verteilung dieses Impfstoffes ist herausfordernd, da BNT162b2 bei sehr niedrigen Temperaturen (-70/ -80°C) transportiert und gelagert werden muss.
Ein weiterer Impfstoff wird voraussichtlich in den nächsten Wochen von der EMA zugelassen: ein mRNA Impfstoff mit dem Namen mRNA-1273 von der Biotech-Firma Moderna entwickelt. Dieser Impfstoff beruht auf einem ähnlichen Wirkmechanismus wie der Wirkstoff BNT162b2. Laut Pressemitteilung der Firma Moderna wurden 30.000 Teilnehmer in die Phase-III-Studie eingeschlossen und es konnte eine Wirksamkeit von 94,5% errechnet werden. Es traten keine schwerwiegenden Nebenwirkungen auf; die meisten berichteten Nebenwirkungen waren Rötungen um die Einstichstelle, Müdigkeit, Abgeschlagenheit, Muskelschmerzen und Kopfschmerzen. Ein Vorteil, den dieser Impfstoff gegenüber BNT162b2 haben dürfte, sind die höheren Lagertemperaturen und somit eine einfachere Logistik.
In weiterer Folge wird auch die Zulassung eines „Vector“-Impfstoffes ( siehe oben) von der Firma Astra/Zeneca erwartet. inwieweit dieser „Lebend“Impfstoff bei Autoimmunerkrankungen und speziell bei MS verwendet werden kann ist derzeit noch unklar
Impfung bei Multipler Sklerose?
Grundsätzlich gilt:
Standardimpfungen sind bei MS-Betroffenen möglich. Als Standardimpfungen werden Impfungen bezeichnet, die durch die Ständige Impfkommission (STIKO) empfohlen sind und die jeder durchführen lassen sollte.
Laut Impfplan sollen in „Phase1“ Menschen mit Risikofaktor für einen schweren Verlauf einer Covid-19 Infektion als erste geimpft werden (MS-Betroffene gehören daher zunächst nicht zum engeren Kreis der Personen, die geimpft werden müssen). Allerdings spielen natürlich auch bei MS Betroffenen Risikofaktoren wie das Alter, Begleiterkrankungen, Einschränkungen der Mobilität und der Lungenfunktion eine Rolle für die Dringlichkeit der Impfung
Bislang gibt es keine Untersuchungen zu Sicherheit und Wirksamkeit von Corona-Impfstoffen unter MS-Therapie. Noch gibt es keine allgemein gültigen Empfehlungen zur Corona-Impfung bei MS, entsprechende Updates werden sind aber zeitnah zu erwarten.
Quellen: MS ges.wien
09.2020
Siponimod:
Der Humanarzneimittelausschuss der EMA empfiehlt, Siponimod zur Behandlung Erwachsener mit sekundär progredienter MS auch in der EU zuzulassen. Die Verschreibung (v.S. Krankenkasse derzeit noch Ablehnung) ist derzeit allerdings in Österreich noch nicht möglich.
13.3.2020 CORONAVIRUS
Einschätzung des Risikos für MS-Betroffene
Nach bisherigen Erkenntnissen gibt es Personengruppen, die ein höheres Risiko für einen schweren Krankheitsverlauf haben. Bezogen auf die MS sind das folgende Personengruppen:
Ältere Personen
Die Fähigkeit des Immunsystems, sich gegen Infektionen der Lunge u.ä. zu wehren, nimmt ab dem 50./60. Lebensjahr ab. Daher können ältere Personen – unabhängig von einer begleitenden anderen Erkrankung – häufiger Komplikationen der Atemwege haben. Da Fieber im höheren Alter seltener auftritt, kann es länger dauern, bis die Erkrankung festgestellt wird.
Personen mit eingeschränkter Beweglichkeit
Menschen, die auf einen Rollstuhl angewiesen oder bettlägerig sind, haben aufgrund der weniger guten Belüftung der Lunge ein erhöhtes Risiko für Atemwegserkrankungen. Da das Corona-Virus Infektionen der Atemwege verursacht, besteht für diese Personen ein erhöhtes Risiko.
Personen mit Medikamenten, die das Immunsystem unterdrücken
Zur Behandlung der MS werden Medikamente eingesetzt, die einen Einfluss auf das Immunsystem haben und die Abwehr gegen Virusinfektionen herabsetzen können. Im Detail bedeutet das folgendes:
Menschen mit Multipler Sklerose ohne immunmodulierende Therapie haben kein erhöhtes Risiko für schwerere Verläufe – es sei denn, es bestehen andere Risikofaktoren wie oben beschrieben (Alter, eingeschränkte Beweglichkeit) oder zusätzliche andere chronische Erkrankungen (z.B. Diabetes, Herz-Kreislauferkrankungen, Lungenerkrankungen, …).
Unter Therapie mit einem Interferon-beta Präparat (Avonex®, Rebif®, Plegridy®, Betaferon®, Extavia®) oder mit Glatirameracetat (Copaxone®, Perscleran®) ist von keinem erhöhten Risiko für einen schweren Verlauf auszugehen.
Bei Dimethylfumarat (Tecfidera®) und Teriflunomid (Aubagio®) und normalen Lymphozytenzahlen (weißen Blukörperchen) ist nicht von einem erhöhten Risiko auszugehen.
Unter Therapie mit Fingolimod (Gilenya®) und Siponimod (Mayzent®) besteht ein erhöhtes Risiko für Infektionen der Atemwege. Die Therapie sollte aber dennoch fortgeführt werden, um eine Wiederkehr der Krankheitsaktivität zu verhindern. In diesen Fällen spielt der Schutz vor einer Infektion (siehe unten „Expositionsprophylaxe“) eine ganz besondere Rolle.
Natalizumab (Tysabri®) führt – nach aktueller Einschätzung – nicht zu einem erhöhten Risiko für Atemwegserkrankungen.
Therapien, die die Zahl der verfügbaren Abwehrzellen über die Dauer der Anwendung hinaus reduzieren (Cladribin (Mavenclad®), off-label Rituximab, Ocrelizumab (Ocrevus®), Alemtuzumab (Lemtrada®), Mitoxantron,Cyclophosphamid) erhöhen das Infektionsrisiko besonders in den ersten Wochennach der Einnahme /Infusion.
Eine Schubtherapie mit hochdosiertem Kortison kann das Infektionsrisiko vorübergehend erhöhen. Inwieweit die Schubtherapie notwendig ist, sollte individuell entschieden werden.
Die Verabreichung bzw. Neueinstellung auf Medikamente, bei denen ein erhöhtes Risiko für einen schweren Verlauf besteht, kann bei entsprechender Nutzen/Risiko-Abwägung verschoben werden.
Nur in Einzelfällen, vor allem wenn mehrere Risikofaktoren (immunsuppressive Therapie, Begleiterkrankungen, Alter, andere besondere Umstände) bestehen, kann eine Therapiepause individuell diskutiert werden. Das individuelle Risiko einer Wiederkehr der Krankheitsaktivität muss hierbei gegen das Infektionsrisiko abgewogen werden. In einer solchen Situation muss besonders Augenmerk auf den Schutz vor einer Infektion („Expositionsprophylaxe“) gelegt werden.
Schutz vor der Infektion mit dem COVID-2019
- Die wichtigste Maßnahme, um die Erkrankung einzudämmen, ist derzeit die sogenannte Expositionsprophylaxe, d.h. den Kontakt mit möglichen Überträgern oder bereits infizierten Personen zu vermeiden.
- Das Corona-Virus wird nach heutigem Stand über Tröpfchen-Infektion übertragen. Daher gelten folgende Schutzmaßnahmen:
- Sehr wichtig ist die Reduktion sozialer Kontakte.
Daher sollen Orte mit engem Kontakt zu anderen Personen (privat, beruflich, öffentliche Veranstaltungen und voll besetzte öffentliche Verkehrsmittel soweit möglich) nach Möglichkeit vermieden werden. Ein Abstand zu anderen Personen von 1 bis 2 Metern wird empfohlen.
- Viele Firmen empfehlen ihren Mitarbeiterinnen und Mitarbeitern, zuhause zu arbeiten. Ab nächster Woche werden Schulen und Kindergärten vorübergehend geschlossen bzw. der Betrieb wird deutlich eingeschränkt. Eine vorübergehende Freistellung vom Arbeitsplatz für MS-Betroffene ist sinnvoll, besonders wenn eine Therapie mit einem immunsuppressiven Medikament besteht.
- Aufsuchen von Ordinationen und Krankenhausambulanzen nur, wenn dringend notwendig
- Reisetätigkeit einschränken
- Regelmäßiges Händewaschen und -Desinfizieren
- Bedecken von Mund und Nase mit Taschentuch oder Ellbogen beim Husten und Niesen
- Lebensmittelhygiene
28.9.2019
Siponimod: Novartis erhält Zulassung für MS-Behandlung in den USA
Siponimod wurde in den USA zur Behandlung von Erwachsenen mit schubförmigen Formen der Multiplen Sklerose (MS) zugelassen, darunter für die aktive sekundär progrediente Multiple Sklerose (SPMS), die schubförmig remittierende MS (RRMS) und das klinisch isolierte Syndrom (CIS). Die Zulassung der US-Arzneimittelbehörde FDA basiert auf den Ergebnissen der Phase-III-Studie EXPAND, einer randomisierten, doppelblinden, Placebo-kontrollierten Studie, an der 1.651 Patienten mit SPMS teilgenommen hatten. SPMS ist eine schwer beeinträchtigende Verlaufsform der MS, die mit einer progressiven und irreversiblen Zerstörung des Nervengewebes einhergeht. Die Studienergebnisse zeigten, dass Siponimod das Risiko einer Krankheitsprogression hinsichtlich der physischen und kognitiven Beeinträchtigung signifikant reduzieren konnte. In den USA ist Siponomid (Mayzent®) seit 15 Jahren die erste zugelassene Therapieoption zur Behandlung der aktiven sekundär progredienten Multiplen Sklerose (SPMS). Auch der Europäischen Arzneimittelbehörde EMA liegt vom Pharmaunternehmen Novartis ein entsprechender Zulassungsantrag vor. Eine Entscheidung wird von Novartis bis Ende 2019 erwartet.
12.7.2019
Ocrelizumab kann im niedergelassenen Bereich ( z.B. in meiner Ordination) einfundiert werden
2.4.2019
OCRELIZUMAB ( Ocrevus) ist ab 1.5 .2019 in der gelben Box (Krankenkassa)
1.9.2018
CLADRIBIN
Cladribin kann künftig in den EU-Staaten vermarktet werden( derzeit in Österreich noch nicht verschiebbar). Das Präparat mit dem Handelsnamen Mavenclad ist zur Behandlung von Erwachsenen mit hochaktiver schubhafter Verlaufsformen der Multiple Sklerose (MS) zugelassen. Das Arzneimittel steht als MS-Patienten als orale Darreichungsform zur Verfügung und könnte die Therapie erleichtern.
Cladribin soll die Häufigkeit der Schübe mindern und so die Krankheitsprogression verzögern.Der Wirkstoff zählt zur Stoffgruppe der Zytostatika. Der aktive Metabolit baut sich als falscher Bestandteil in die DNA ein und hemmt die Zellteilung. Das Arzneimittel beeinflußt so vermutlich durch Reduktion der Anzahl von T- und B-Lymphozyten Entzündungen im zentralen Nervensystem. Auch auf das Zytokinprofil könne Cladribin Einfluss nehmen und so antientzündlich wirken. Die Wirkung konnte in Studien mit >1300 Patienten mit schubförmiger remittierender MS (RRMS)bestätigt werden.
Die Patienten erhalten innerhalb von vier Jahren lediglich in zwei aufeinanderfolgenden Jahren über jeweils einen kurzen Zeitraum die Substanz in Tablettenform. Nebenwirkungen der Behandlung: Lymphopenie, Infektionen, Hautausschläge und Herpes zoster sind möglich.
30.3.2017
update Ocrelizumab
In den Vereinigten Staaten erhielt der Antikörper Ocrelizumab die Zulassung zur Therapie der primär progredienten MS (PPMS) und der remittierend schubförmig verlaufenden MS (RRMS). In Eurpoa steht die Zulassung bevor, ein datum für die Verschreibbarkeit in Österreich ist noch offen.
Ocrelizumab ist das erste und einzige Arzneimittel, das gegen beide Verlaufsformen der Multiplen Sklerose, also die schubförmige und die primär progrediente, wirkt. Insbesondere für Patienten mit primär progredienter MS ist Ocrelizumab ein Therapie-Durchbruch: Diese Unterform der Multiplen Sklerose galt bis dato als nicht behandelbar. Etwa zehn bis 15 Prozent der Patienten leiden an der primär progredienten Form.
Im Gegensatz zur remittierend schubförmigen MS entwickeln sich die neurologischen Symptome bei der PPMS eher schleichend. Die PPMS beginnt meist erst in einem Alter von 40 bis 50 Jahren und trifft Männer und Frauen mit gleicher Häufigkeit – bei der RRMS erkranken Frauen im Schnitt dreimal häufiger als Männer. Auch beginnt die RRMS meist früher im Alter zwischen 20 und 40 Jahren.
Wirkmechanismus von Ocrelizumab: Als humanisierter, monoklonaler Antikörper richtet sich Ocrelizumab gegen das auf B-Zellen exprimierte, glykosylierte Phosphoprotein CD20. B-Zellen spielen – als Aktivatoren autoreaktiver T-Zellen – eine wichtige Rolle in der Pathogenese der Multiplen Sklerose.
Patienten können das Medikament nicht selbst spritzen. Ocrelizumab muss vom Arzt verabreicht werden. Alle sechs Monate erhalten MS-Patienten eine Infusion mit 600 mg des Antikörpers. Die Startdosis wird in zwei Dosen zu je 300 mg aufgeteilt und in zweiwöchigem Abstand infundiert.
13.6.2016
Ocrelizumab:
http://www.amsel.de/multiple-sklerose-news/medizin/Ocrelizumab-bei-Multipler-Sklerose_5929
25.9.2015
Ab 1.10 2015 steht COPAXONE® 40mg/ml zur 3x wöchentlichen subkutanen Verabreichung wird ab 1. Oktober von den Kassen erstattet.
COPAXONE® 40 mg/ml 3x wöchentlich bietet das bewährte Wirksamkeits- und Sicherheitsprofil von COPAXONE® 20mg/ml 1x täglich1, ist aber durch die geringere Injektionsfrequenz im Head-to-Head Vergleich zu 20mg/ml täglich noch verträglicher:
Die GLACIER Studie hat gezeigt, dass die Rate der annualisierten injektionsbezogenen Ereignisse bei COPAXONE® 40mg/ml 3x wöchentlich um 50% geringer ist als bei der täglichen Anwendung von 20mg/ml. Die Anzahl der moderaten und schweren injektionsbezogenen Ereignisse (definiert als solche, die das tägliche Leben einschränken oder behindern) war unter COPAXONE® 40mg/ml 3x wöchentlich sogar um 77% geringer.2
COPAXONE® 40mg/ml 3x wöchentlich ist angezeigt zur Behandlung von schubförmiger Multipler Sklerose. Es ist nicht angezeigt bei primär oder sekundär progredienter MS
12.7.2019
Ocrelizumab kann im niedergelassenen Bereich ( z.B. in meiner Ordination) infundiert werden
2.4.2019
OCRELIZUMAB ( Ocrevus) ist ab 1.5 .2019 in der gelben Box (Krankenkassa)
30.3.2017
update Ocrelizumab
In den Vereinigten Staaten erhielt der Antikörper Ocrelizumab die Zulassung zur Therapie der primär progredienten MS (PPMS) und der remittierend schubförmig verlaufenden MS (RRMS). In Eurpoa steht die Zulassung bevor, ein datum für die Verschreibbarkeit in Österreich ist noch offen.
Ocrelizumab ist das erste und einzige Arzneimittel, das gegen beide Verlaufsformen der Multiplen Sklerose, also die schubförmige und die primär progrediente, wirkt. Insbesondere für Patienten mit primär progredienter MS ist Ocrelizumab ein Therapie-Durchbruch: Diese Unterform der Multiplen Sklerose galt bis dato als nicht behandelbar. Etwa zehn bis 15 Prozent der Patienten leiden an der primär progredienten Form.
Im Gegensatz zur remittierend schubförmigen MS entwickeln sich die neurologischen Symptome bei der PPMS eher schleichend. Die PPMS beginnt meist erst in einem Alter von 40 bis 50 Jahren und trifft Männer und Frauen mit gleicher Häufigkeit – bei der RRMS erkranken Frauen im Schnitt dreimal häufiger als Männer. Auch beginnt die RRMS meist früher im Alter zwischen 20 und 40 Jahren.
Wirkmechanismus von Ocrelizumab: Als humanisierter, monoklonaler Antikörper richtet sich Ocrelizumab gegen das auf B-Zellen exprimierte, glykosylierte Phosphoprotein CD20. B-Zellen spielen – als Aktivatoren autoreaktiver T-Zellen – eine wichtige Rolle in der Pathogenese der Multiplen Sklerose.
Patienten können das Medikament nicht selbst spritzen. Ocrelizumab muss vom Arzt verabreicht werden. Alle sechs Monate erhalten MS-Patienten eine Infusion mit 600 mg des Antikörpers. Die Startdosis wird in zwei Dosen zu je 300 mg aufgeteilt und in zweiwöchigem Abstand infundiert.
13.6.2016
Ocrelizumab:
http://www.amsel.de/multiple-sklerose-news/medizin/Ocrelizumab-bei-Multipler-Sklerose_5929
25.9.2015
Ab 1.10 2015 steht COPAXONE® 40mg/ml zur 3x wöchentlichen subkutanen Verabreichung wird ab 1. Oktober von den Kassen erstattet.
COPAXONE® 40 mg/ml 3x wöchentlich bietet das bewährte Wirksamkeits- und Sicherheitsprofil von COPAXONE® 20mg/ml 1x täglich1, ist aber durch die geringere Injektionsfrequenz im Head-to-Head Vergleich zu 20mg/ml täglich noch verträglicher:
Die GLACIER Studie hat gezeigt, dass die Rate der annualisierten injektionsbezogenen Ereignisse bei COPAXONE® 40mg/ml 3x wöchentlich um 50% geringer ist als bei der täglichen Anwendung von 20mg/ml. Die Anzahl der moderaten und schweren injektionsbezogenen Ereignisse (definiert als solche, die das tägliche Leben einschränken oder behindern) war unter COPAXONE® 40mg/ml 3x wöchentlich sogar um 77% geringer.2
COPAXONE® 40mg/ml 3x wöchentlich ist angezeigt zur Behandlung von schubförmiger Multipler Sklerose. Es ist nicht angezeigt bei primär oder sekundär progredienter MS
01.08.2015
Tecfidera (Fumarsäure) und Aubagio Teriflunomid) sind nunmehr „gelbe box“und somit verschreibbar
28.12.2014
Fumarsäure/TECFIDERA
Tecfidea ist nun zugelassen für die Behandlung der schubhaften MS aber in Österreich derzeit nur unter gewissen Bedinungen verschreibbar (Kostenübernahme durch die Kasse derzeit noch problematisch). Im Einzelfall Verschreibung jedoch argumentierbar!
28.12.2014
Kommentar zu Lemtrada:
Alemtuzumab/Lemtrada bleibt Spezialindikationen vorbehalten! Das Nebenwirkungsspektrum ist umfangreich ( es können u.a. zusätzliche u.U. gefährliche Autoimmunerkrankungen – Schilddrüse, Niere und Blutplättchen- unter Therapie aktiviert werden. Der Monitoraufwanf ist hoch: Laborkontrolle 1x/Monat über 5 Jahre!!
Die Verabreichung erfolgt ausschließlich im Rahmen eines Spitalsaufenthaltes (Infusionen über 5 Tage im ersten Zyklus, ein Jahr später nochmals über 3 Tage)
Es gilt eine strenge Risiko/Nutzen Abwägung!!
01.04.2014 Alemtuzumab/Lemtrada
Alemtuzumab (Lemtrada)
Alemtuzumab ist ein gentechnisch hergestellter monoklonaler Antikörper, der sich gegen die Zelloberfläche von Lymphozyten richtet. Als Wirkungsmechanismus wird angenommen, dass sich durch die Bindung des Wirkstoffes an B- und T-Lymphozyten, diese für das körpereigene Immunsystem gekennzeichnet sind was in der Folge zu deren Unterdrückung/Entfernung führt (im Verlauf kommt es dann wieder zur Neubildung von T und B Lymphozyten). Vor allem die sogenannten CD4+ Zellen werden sehr lange unterdrückt, CD4+ Zellen sollen jene T-Zellen sein, die bei der Auslösung der Entzündung und damit des MS-Schubes beteiligt sind.
Attraktiv erscheint die Verabreichung („1x/jahr“): 1 Therapiezyklus pro Jahr (1.Zyklus: Infusionen täglich über 5 Tage; weitere Zyklen: 3 Tage). Kann nur in MS-Kliniken verabreicht werden
Das Fortschreiten der Erkrankung kann- wie für alle derzeit zu Verfügung stehenden MS-Therapien geltend- nicht gestoppt sondern „nur“ verlangsamt werden. Berücksichtigt werden muß das nicht ganz unproblematische Nebenwirkungsprofil des Medikamentes: Vor allem das Auftreten anderer Autoimmunerkrankungen unter Therapie-speziell Schilddrüsenerkrankungen und Blutungskomplikationen bedingt durch Abfall der Blutplättchen- erfordern ein sehr engmaschiges Patientenmonitoring über Jahre! Daten zur Langzeittherapie liegen naturgemäß derzeit noch nicht vor.
Neuer (in Österreich noch nicht zugelassener) Monoklonaler Antikörper zur Behandlung der schubhaften MS
Neues (in Österreich noch nicht zugelassener) Therapeutikum zur Behandlung der schubhaften MS
Fingolimod (Gilenya): ist derzeit für die Eskalationstherapie und nicht als primäres Basismedikamentbei schubhafter MS vorgesehen.
Die Zulassungsstudien ergaben, dass Fingolimod (Gilenya®) teilweise zu gefährlichen Nebenwirkungen führen kann, so zum Beispiel am Herzen. Vor allem deshalb ist das Medikament nach aktueller Einschätzung nicht als Basismedikament geeignet.
Ein in Tablettenform einzunehmendes Basismedikament wäre zwar sehr wünschenswert. Doch ist das Risiko bei einer breiteren Anwendung dieses Wirkstoffs höher als das der empfohlenen Basismedikamente wie Interferon/Copaxone. In Europa ist Fingolimod deshalb ein Medikament der sogenannten Zweitlinienbehandlung, ähnlich wie Natalizumab. Diese Wirkstoffe werden also nur dann eingesetzt, wenn die Basistherapie nicht oder nicht ausreichend wirkt oder die Krankheit sehr aktiv ist.
Die Wirksamkeit von Fingolimod ist, wenn man die zwei Zulassungsstudien betrachtet, relativ gut: Im Vergleich zu einem Plazebo-Präparat (Scheinmedikament) ergab sich eine um 54% höhere Wirksamkeit. Im direkten Vergleich mit Interferon-Präparaten schnitt Finglimod um 38% bis 52% besser ab. In der MRT-Untersuchung ließen sich weniger Läsionen nachweisen und der Behinderungsgrad war tendenziell verringert.
Eine sogenannte Eskalationstherapie kann dann notwendig sein, wenn es trotz der Behandlung mit Basismedikamenten wie Interferon oder Copaxone zu einer Krankheitsprogression kommt. Dann ist Fingolimod (Gilenya®/ ) eine Option. Die erste Einnahme erfolgt unter ärztlicher Beobachtung (derzeit üblicherweise im Rahmen einer stationären Spitalsaufnahme für einen Tag), weil es besonders in den ersten sechs Stunden nach der ersten Einnahme unter anderem zu einem Absinken der Herzfrequenz kommen kann. Damit ist auch gleich eine der gefährlichsten Nebenwirkungen genannt und daran wird deutlich, dass es auch Nachteile gibt.
Zum Wirkmechanismus: Fingolimod ist wie alle anderen Medikamente der Eskalationstherapie ein Immunsuppressivum. Das spezielle Wirkprinzip: Die Substanz hindert Lymphozyten daran, ins Blut und ins Nervensystem zu gelangen, wo diese Immunzellen an der Zerstörung der Nervenscheiden beteiligt sind. Das Medikament entfaltet seine Wirkung auch in der Gehirn-Rückenmarks-Flüssigkeit (Liquor). Damit ist Fingolimod direkt am Ort des Geschehens wirksam.
Unter Therapie mit Fingolimod (GILENYA) sind folgende Kontrolluntersuchungen notwendig:
Kontrolle Blutlabor:
2. und 4. Woche nach Therapiebeginn, dann alle 3Monate
MR-Kontrolle:
1xJährlich
Klinisch neurologische Kontrolle:
Nach dem ersten Behandlungsmonat, dann alle 3-6 Monate
Augenärztliche Kontrolle:
Obligat nach 3-4 Monaten unter Therapie mit Gilenya
Hautarzt:
Nach 1 Jahr (bei Neuauftreten unklarer umschriebener Hautveränderungen sofort)
Bei Autreten einer Gürtelrose*:
Sofortige Kontaktaufnahme mit behandelndem Arzt/Hausarzt
* Beginnt mit heftigem zumeist gürtelförmigen „Nervenschmerz“ (Auftreten auch im Gesichtsbereich möglich!)
FUMARSÄURE
Eine der neuen oralen Therapieoptionen ist die Fumarsäure BG12, die zur Zeit in Studien der Phase III getestet wird. Sie ist aus der Dermatologie (Hauterkrankungen) seit langem bekannt, wurde ursprünglich zur Behandlung der Schuppenflechte entwickelt. Fumarsäure hat positive Effekte auf verschiedene Aspekte der Entzündungsreaktion, für die MS relevant sind. Außerdem wird vermutet, dass Fumarsäure neuroprotektiv wirkt. Neuroprotektiv bedeutet: „die Nervenzellen schützend“.
An einer ersten Phase II-Studie zu Wirksamkeit und Verträglichkeit von BG 12 bei schubförmiger MS nahmen 257 Patienten in Europa teil. Sie erhielten über sechs Monate entweder täglich Placebo oder Fumarsäure in unterschiedlicher Dosierung. Die Einteilung in die verschiedenen Gruppen erfolgte nach dem Zufallsverfahren. Am günstigsten schnitten die Patienten mit der höheren Dosierung ab: Bei ihnen verringerte sich die durchschnittliche Anzahl neuer Entzündungsherde um 69% gegenüber Placebo. Auch die Schubhäufigkeit war in dieser Therapiegruppe um 32% verringert, was allerdings auch Zufall sein konnte.
Zur Zeit laufen weltweite Studien der Phase III, die insgesamt über 2.000 Patienten einschließen sollen. Dabei handelt es sich um placebo-kontrollierte Dosisvergleichsstudien, die über jeweils 24 Monate geführt werden. Ergebnisse werden für 2012 erwartet.
FAMPYRA
Was ist Fampyra?Fampyra ist ein Arzneimittel, das den Wirkstoff Fampridin enthält. Es ist als Retardtablette (10 mg) erhältlich.
Wofür wird Fampyra angewendet? Fampyra wird zur Verbesserung der Gehfähigkeit von erwachsenen Patienten mit Multipler Sklerose (MS) mit Gehbehinderung angewendet. MS ist eine Nervenkrankheit, bei der die Schutzhülle um die Nerven entzündungsbedingt zerstört wird. Das Arzneimittel ist nur auf ärztliche Verschreibung erhältlich.
Wie wird Fampyra angewendet? Die Behandlung mit Fampyra sollte von einem Arzt verschrieben und überwacht werden, der Erfahrung in der Behandlung von MS besitzt. Die empfohlene Dosis beträgt eine Tablette oral zweimal täglich im Abstand von 12 Stunden. Die Tabletten sind ohne Nahrung einzunehmen. Die Patienten sind nach zwei Wochen zu beurteilen. Bei Patienten, bei denen keine Besserung eingetreten ist, sollte die Behandlung abgesetzt werden. Die Behandlung ist auch dann abzusetzen, wenn sich die Gehfähigkeit eines Patienten verschlechtert oder der Patient keinen Nutzen feststellt.
Wie wirkt Fampyra? Die Muskeln des Körpers ziehen sich zusammen, wenn elektrische Impulse entlang der Nerven zu den Muskeln weitergeleitet worden sind. Bei MS ist die Übertragung elektrischer Impulse beeinträchtigt, wenn die Schutzhüllen um die Nerven geschädigt sind. Dies kann zu Muskelschwäche, Muskelsteifigkeit und Gehschwierigkeiten führen.
Der Wirkstoff in Fampyra, Fampridin, ist ein Kaliumkanalblocker. Er wirkt auf geschädigte Nerven, wo er verhindert, dass geladene Kaliumteilchen aus den Nervenzellen entweichen. Es wird angenommen, dass dadurch die elektrischen Impulse weiter an den Nerven entlang wandern können, um die Muskeln zu stimulieren, sodass das Gehen erleichtert wird.
Wie wurde Fampyra untersucht? Die Wirkungen von Fampyra wurden zunächst in Versuchsmodellen getestet, bevor sie an Menschen untersucht wurden. Das Unternehmen verwendete außerdem Daten aus der wissenschaftlichen Fachliteratur. Es wurden zwei Hauptstudien durchgeführt, in denen Fampyra bei 540 Patienten mit Multipler Sklerose mit einem Placebo (Scheinbehandlung) verglichen wurde. Die Patienten wurden neun oder 14 Wochen lang behandelt. Der Hauptindikator für die Wirksamkeit beruhte auf der Verbesserung der Gehgeschwindigkeit auf einer Strecke von etwa 7,5 Metern. Ein Ansprechen auf die Therapie lag definitionsgemäß vor, wenn die Gehgeschwindigkeit der Patienten bei drei von vier Untersuchungen schneller als ihre maximale Geschwindigkeit vor der Behandlung war.
Welchen Nutzen hat Fampyra in diesen Studien gezeigt? Fampyra konnte die Gehgeschwindigkeit wirksam verbessern. In einer der Hauptstudien sprachen etwa 35 % der mit Fampyra behandelten Patienten auf die Behandlung an, während dies in der Placebogruppe bei 8 % der Patienten der Fall war. In der zweiten Studie fielen die Ergebnisse ähnlich aus. Von den Patienten in der mit Fampyra behandelten Gruppe sprachen 43 % auf die Behandlung an, gegenüber 9 % in der Placebogruppe.
Welches Risiko ist mit Fampyra verbunden? Die Nebenwirkungen von Fampyra sind überwiegend neurologischer Art (stehen in Zusammenhang mit dem Gehirn oder den Nerven), u. a. Krämpfe (Anfälle), Insomnie (Schlafstörungen), Angststörung, Gleichgewichtsprobleme, Schwindel, Parästhesie (ungewöhnliche Sinneswahrnehmungen wie Nadelstiche), Zittern, Kopfschmerz und Asthenie (Schwäche). Die häufigste Nebenwirkung, die aus klinischen Studien berichtet wurde und bei etwa 12 % der Patienten auftrat, sind Harnwegsinfekte. Die vollständige Auflistung der im Zusammenhang mit Fampyra berichteten Nebenwirkungen ist der Packungsbeilage zu entnehmen.
Fampyra darf nicht bei Patienten angewendet werden, die möglicherweise überempfindlich (allergisch) gegen Fampridin oder einen der sonstigen Bestandteile sind. Es darf nicht zusammen mit anderen Fampridin enthaltenden Arzneimitteln oder mit Arzneimitteln angewendet werden, die als „Inhibitoren des organischen Kationentransporters 2“ wie etwa Cimetidin bekannt sind. Es darf nicht bei Patienten mit akuten oder in der Vergangenheit aufgetretenen Krampfanfällen oder bei Patienten mit Nierenproblemen angewendet werden
PML („progressive multifokale Leukoenzephalopathie“), was ist das?
Die „progressive multifokale Leukoenzephalopathie“ ist eine vorzugsweise die weiße Substanz des Gehirns betreffende Viruserkrankung, welche fast nur bei Patienten mit beeinträchtigtem Immunsystem vorkommt. Dies kann im Rahmen einer HIV-Infektion sein, aber auch bei anderen immunschwächenden Situationen wie etwa bei einer immunsuppressiven Therapie nach Organtransplantation, bei Chemotherapie und eben auch unter Therapie mit Monoklonalen Antikörper (Natalizumab) zur Behandlung hochaktiver MS- Patienten. Progressiv bedeutet, dass die Krankheit fortschreitet (meist leider ungehindert). Multifokal deutet darauf hin, dass verschiedenste Bereiche im Gehirn betroffen sein können.
Ursache ist eine Reaktivierung des sog. JC-Virus (benannt nach den Initialen des ersten Patienten). Die Erstinfektion verläuft meist völlig unauffällig. Erst bei Immunschwäche kann sich das Virus reaktivieren. Dabei kommt es zur Zerstörung der die Nervenzellen umhüllenden Zellen. (Entmarkungskrankheit). Je nachdem, welches Gebiet betroffen ist kommen entsprechende Ausfälle zustande. Wenn z.B. das Sprachzentrum betroffen ist, wird es hier Probleme geben. Wie gesagt kann die Krankheit an verschiedenen Orten im Gehirn („multifokal“) auftreten. Bei klinischem Verdacht wird eine Magnetresonanz des Gehirns und eine Laboruntersuchung (Liquor: JC Virus PCR Bestimmung) zur Sicherung der Dignose durchgeführt.
Derzeit steht noch keine spezifische Therapie der PML zu Verfügung. Im Erkrankungsfall muß Natalizumab umgehend abgesetzt und eine Blutwäsche zur möglichst raschen und vollständigen Entfernung der Substanz aus dem Organismus durchgeführt werden. Die Prognose ist leider dennoch oftmals schlecht (schwere Beeinträchtigung, aber auch Todesfall möglich). Bei MS-Patienten besteht jedoch seit kurzem die Möglichkeit einer sogenannten Risikostratifizierung also ein Wekzeug für die individuellen PML-Risiko Einschätzung zu Verfügung! (s.u.)
Eine frühzeitige Diagnose ist entscheidend! Grundlage hierfür ist die wiederholte Aufklärung des Patienten und! seiner Angehörigen sowie die engmaschige klinische Kontrollen beim behandelnden Neurologen unter laufender Therapie mit Natalizumab!
Risikostratefizierung (Einschätzung) vor/unter Therapie mit Natalizumab
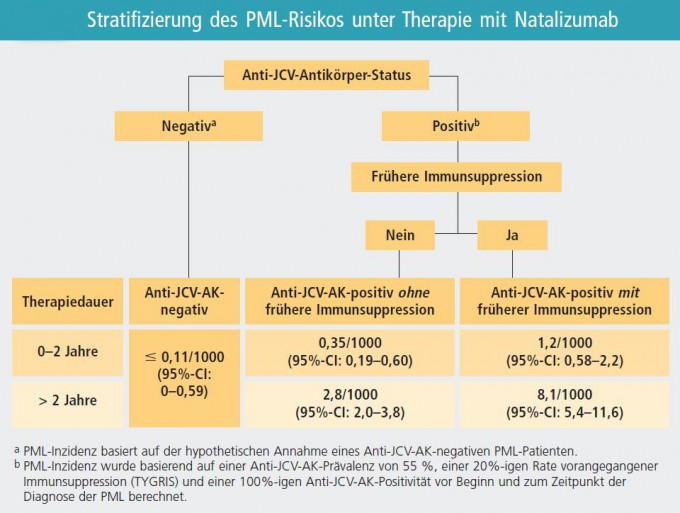
Natalizumab (Tysabri®) ist ein hoch wirksames Medikament zur Behandlung der schubförmigen Multiplen Sklerose. Als unerwünschte Arzneimittelwirkung kann unter Behandlung mit diesem Medikament eine Progressive Multifokale Leukenzephalopathie (PML) auftreten, eine durch das JC-Virus (JCV) vermittelte, schwere Infektionserkrankung des Gehirns.
Nach gegenwärtiger Datenlage kann davon ausgegangen werden, dass etwa 50-60% der Bevölkerung (und somit auch der MS-Betroffenen) das Virus in sich tragen („Durchseuchung“). Diese Personen bilden im Test nachweisbare Antikörper gegen das JC Virus. Die allermeisten dieser Virusträger sind allerdings völlig gesund. Schon daher sollte es Ziel sein, diesen Antikörpertest nur dann anzuwenden, wenn sich aus dem Ergebnis der Testung auch tatsächlich eine konkrete Therapiekonsequenz zum Nutzen des Patienten ergibt. Nach bisherigen Erkenntnissen bedeutet ein positiver anti-JCV-Antikörper-Befund ein leicht erhöhtes PML-Risiko, was aber nicht zwingend eine Therapie mit Natalizumab verbietet. Die einzige Patientengruppe, für die sich zur Zeit eine klare Empfehlung hinsichtlich der Bestimmung der anti-JCV-Antikörper geben lässt, sind MS Patienten mit zusätzlichen Risikofaktoren, und zwar solche, die
a) vor Beginn der Natalizumab-Therapie mit einem Immunsuppressivum (dazu gehören z.B. Mitoxantron und Azathioprin; nicht jedoch Interferon-beta, Glatirameracetat oder Kortison) behandelt wurden, und die
b) bereits über mehr als zwei Jahre mit Natalizumab behandelt wurden.
Fällt bei solchen Patienten die Testung positiv aus, wäre ein Aussetzen oder Absetzen einer Natalizumab-Behandlung zu diskutieren. Dies sollte jedoch in Absprache mit einem erfahrenen MS-Therapiezentrum erfolgen, da ein einfaches Absetzen von Natalizumab das Risiko eines Wiederauftretens von vermehrter Krankheitsaktivität in sich birgt und daher alternative Therapiemöglichkeiten mit betroffenen Patienten diskutiert werden müssen. Umgekehrt bedeutet ein negativer Test selbstverständlich keinesfalls die Garantie, dass sich nicht doch unter Natalizumab eine PML entwickeln kann. Dieses Risiko erscheint allerdings bei negativem anti-JCV-Antikörper-Befund nach aktuellem Wissenstand sehr gering. Auch sollte bei einem negativen Testergebnis jährlich eine Nachbestimmung erfolgen, da von einem jährlichen Anstieg der Durchseuchung der Bevölkerung (und somit Anteil der anti-JCV-Antikörper-Positiven) um etwa 2-3 Prozent auszugehen ist.
Fazit
Der Bluttest zum Nachweis von anti-JCV-Antikörpern zeichnet sich als neues Werkzeug zur Abschätzung des individuellen PML Risikos unter Therapie mit Natalizumab ab. Wie bei anderen neu eingeführten medizinischen Testmethoden muss auch dieses Verfahren zunächst in weiteren Studien validiert werden, um seinen Stellenwert für die Erarbeitung konkreter individueller Risikoprofile hinreichend sicher einschätzen zu können. In jedem Fall kommt es entscheidend darauf an, dass dieser Test sinnvoll und gezielt eingesetzt wird. Ausserdem sind die konkreten Konsequenzen dieser Untersuchung – insbesondere die Bedeutung eines etwaigen positiven Testergebnisses – schon im Vorfeld mit den Betroffenen kritisch zu besprechen.
